Les océans absorbent une partie du CO2 émis par les humains, atténuant ainsi le réchauffement climatique des gaz à effet de serre (GES) présents dans l’atmosphère. Mais cette absorption n’est pas sans conséquences : elle provoque une acidification de l’eau de mer et une diminution des ions carbonate disponibles, deux phénomènes qui représentent une menace aussi importante que le réchauffement de la planète. En effet, ces modifications chimiques ont et auront des répercussions importantes sur la faune et la flore marine, notamment pour les organismes qui possèdent une coquille ou un squelette de carbonate de calcium.
Lire la version PDF de l’article
Le pH des océans n’est pas uniforme
Le pH (ou potentiel d’hydrogène) mesure le caractère acide ou basique de l’eau. Le pH est compris entre 0 et 14. Les valeurs inférieures à 7 correspondent à de l‘eau acide, les valeurs supérieures à 7 à de l’eau basique. Les conditions dites physiologiques correspondent à un pH de 7.4.
Le pH moyen des océans est de 8,16, soit légèrement basique. Cependant, le pH n’est pas le même partout autour de la planète et il varie avec la profondeur. La figure ci-dessous montre les variations en fonction de la longitude et la latitude (figure du haut) et en fonction de la profondeur (figure du bas).
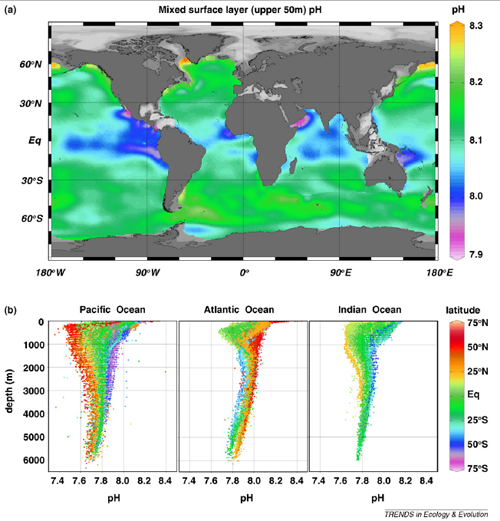
Les variations horizontales sont le résultat principalement des variations de températures et du brassage vertical des eaux océaniques. Certaines zones sont particulièrement soumises à ce régime dans lequel les eaux froides du fond marin, riches en carbone inorganique dissout et caractérisées par un pH bas, remontent vers la surface. Ce phénomène est bien visible sur la côte est de l’océan Pacifique, près des côtes de la Somalie et du sultanat d’Oman et sur la côte ouest du continent africain.
Pour les régions moins affectées par ce mouvement d’advection, les régions où la production biologique est la plus importante tendent à être caractérisées par les valeurs de pH les plus hautes. La fixation du carbone inorganique dissout par le phytoplancton est transporté vers les profondeurs (un phénomène appelé « pompe biologique »), ce qui accroît le pH de surface.
Ce processus influence aussi le pH des profondeurs. Comme le montre la figure du bas, le pH à tendance à diminuer lorsqu’on descend vers le fond océanique. On peut observer également une réduction progressive de l’étendue de la variation du pH pour des couches d’eau situées plus en profondeur. Cette caractéristique laisse supposer que les contraintes que peut supporter la faune et la flore benthique et que leur tolérance aux variations de leur environnement sont plus faibles que celles les espèces vivant plus en surface. Cet aspect est certainement à prendre en considération quand on considère les changements climatiques et la détérioration de l’environnement.
Le pH des océans présentent également des variations cycliques d’amplitude et de périodicité différentes qui dépendent de la température, des courants marins verticaux et horizontaux, du ruissellement des fleuves, de la fonte des glaces, de la photosynthèse et de la calcification. Ces variations sont accentuées près des côtes.
Le CO2 dissout diminue le pH des océans
Les océans absorbent 50% du dioxyde de carbone (CO2 ou gaz carbonique) émis par les énergies fossiles, soit 30% du CO2 si on considère les changements d’utilisation des terres comme la déforestation. Ainsi, à l’instar des aérosols présents dans l’atmosphère, les océans limitent l’augmentation de la température planétaire résultant de l’effet de serre.
À mesure que du CO2 se dissout dans les mers et océans, l’eau devient plus acide (son pH diminue). La réaction en cause produit de l’acide carbonique (H2CO3) comme suit :
CO2 + H2O ↔ H2CO3
Et celui-ci se dissout dans l’eau en formant des ions bicarbonate (HCO3-) selon la réaction :
H2CO3 ↔ HCO3- + H+
C’est l’augmentation de la concentration en protons H+ qui réduit le pH de l’eau (pH – log [H+]).
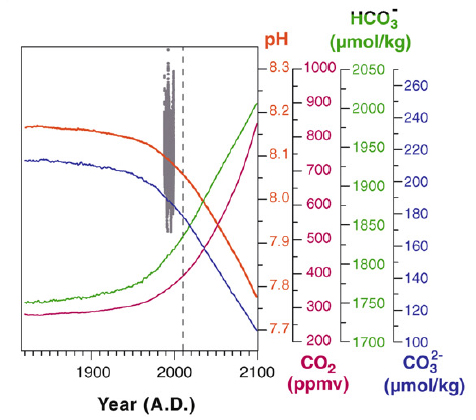
La valeur normale du pH moyen des océans, si on se réfère aux époques géologiques, est 8,16, une valeur correspondant à un pH très légèrement basique. Depuis l’ère industrielle, le pH a diminué de 0,1 unité, une modification très significative. Actuellement, la diminution du pH est d’environ 0,017 à 0,02 unités par décennies, mais le phénomène est plus rapide aux hautes latitudes.
Un tel changement du pH affecte les organismes, les écosystèmes marins et les réseaux trophiques. Par exemple, le stade larvaire de certains organismes est très dépendant de son environnement physico-chimique. On observe ainsi une diminution de la fertilisation causée par la perturbation de la structure squelettique ou de la coquille de certaines larves.
La réduction du pH affecte également l’éclosion des larves, leur développement, et l’étape de colonisation de leur milieu. Elle peut également altérer des processus tels que le transport des ions, l’activité des enzymes et la structure des protéines. De plus, les détériorations subies par une espèce peuvent avoir des répercussions sur la chaîne alimentaire et donc sur d’autres espèces.
Par ailleurs, la valeur du pH océanique n’est pas uniforme ni autour du globe, ni en profondeur, ni dans le temps. La diminution du pH affecte et affectera donc plus certaines régions que d’autres. Les latitudes les plus élevées par exemple connaîtront les changements les plus importants alors que les tropiques seront moins affectés.
Le CO2 dissout affecte la disponibilité des ions carbonate
En plus des réactions ci-dessus résultant de la dissolution du CO2 dans l’eau, les ions hydrogène H+ se lient aux molécules de carbonate pour former du bicarbonate :
CO32- + H+ ↔ HCO3-
Le bilan net des réactions est une perte progressive d’ions carbonate. Les conséquences pour les organismes qui dépendent de la calcification (ptéropodes, foraminifères, coccolithophoridés, coraux, etc.) sont critiques.

En effet, de nombreux organismes marins précipitent le carbonate de calcium sous la forme de calcite ou d’aragonite. La stabilité de ces structures (leur probabilité de se former ou de se dissoudre) est directement reliée à l’état de saturation des océans en ions calcium (Ca2+) et carbonate, les deux espèces qui forment le minéral. Cet état de saturation se mesure par :
W = [Ca2+].[ CO32-] / Ksp, où Ksp est la solubilité de chaque phase minérale.
– Si W = 1, le carbonate ni ne se forme ni se dissout
– Si W > 1 (conditions actuelles), la précipitation du calcium est thermodynamiquement favorisée
– Si W < 1 (conditions de sous-saturation), la précipitation est défavorable.
Il est à noter cependant que la valeur de W optimale dépend de l’espèce considérée. Les barrières coralliennes par exemple demandent des valeurs de W supérieures à 3,3 pour leur développement, car dans ce cas le processus de calcification doit être supérieur au taux d’érosion.
À mesure que les océans absorbent le CO2, l’état de saturation diminue, altérant le mécanisme de calcification et ainsi le développement de certains organismes. Ces problèmes risquent de conduire in fine à des déplacements de population d’espèces et à des perturbations de la chaîne alimentaire.
Les barrières de coraux sont les organismes les plus à risque. Cela vient notamment du fait que le taux d’érosion du corail représente 90% du taux de calcification. Par suite, une modification même mineure du taux de calcification peut se répercuter en un bilan de carbonate négatif pour le corail. L’effet est accru lorsque par une hausse des températures. Le corail ne peut alors se renouveler et disparaît progressivement. C’est exactement ce que nous vivons à l’heure actuelle.
Il est inquiétant de constater que la barrière corallienne des tropiques a diminué de 30 à 50% depuis le début des années 80. Les scientifiques prédisent une disparition totale du corail si la concentration en CO2 dans l’atmosphère approche 450 ppm (la teneur actuelle est 380 ppm, elle était de 280 ppm avant la révolution industrielle).
Les conséquences de cette disparition incluent la perte de milliers d’espèces qui ont le corail pour habitat. La disparition du corail va également modifier les côtes puisqu’ils représentent des barrières naturelles qui protègent les mangroves et les herbiers marins. Le corail est certainement une sentille pour avertir des profondes modifications du milieu marin qui s’opèrent actuellement.
Sources :
- Pelejero C., Calvo E. et Hoegh-Guldberg O. Paleo-perspectives on ocean acidification, Trends in Ecology and Evolution (2010) 25 332-344 | Résumé >>
- The Ocean Acidification Network : http://ioc3.unesco.org/oanet/FAQacidity.html.




L effet de avalanche peut accélérer ces phénomènes et atteindre le seuil de non retour plus vite que prévu
Le seule remède reste l éducation des plus jeunes; concernant les vieux con c est trop tard;
Alors vive les toilettes sèches
Les circuit court la sobriété agricole le fret par rail
Et aba le plastique.
Il y a quelque chose qui m’intrigue quand même dans cette analyse. Il est dit qu’une valeur inférieur à 7 est acide, d’accord bien compris. j’ai pas été bien loin en chimie mais la je suis.
ensuite vous dite que le ph diminue de 0,02 par décennie. donc pour supposer que les océans tombe dans du acide. La moyenne est à 8,16 1,16/0,02= 58 décennies… d’accord il faut y réfléchir mais ça sent un peu l’analyse dramatique.
Qu’on nous parle d’épuisement des ressources, la on est d’accord. Mais la planète semble bien se réguler toute seul ?
Merci de votre intérêt dans cet article, qui ne se veut pas tant « dramatique » (même s’il y a de quoi), mais surtout informatif.
En fait, la question n’est pas que l’eau devienne « acide » à partir d’une valeur donnée (le pH 7 est une valeur définie par les physico-chimistes), le problème est que l’eau tende à devenir plus acide (moins basique), car cela affect la vie marine. Le problème est même que le pH de l’eau évolue dans le temps, car cela affecte les conditions de vie d’espèces qui ont évolué et ont prospéré dans un environnement qui prévalait avant que les activités humaines aient un impact tel qu’elles modifient la nature et les processus qui gouvernent la planète, et ce à une vitesse qui n,a aucune commune mesure avec les échelles de temps d’évolution géologique.
Ce qui est trompeur avec le pH c’est que de petites variations cachent en fait de grandes variation de concentration des espèces chimiques. C’est ainsi que la variation de pH de 0,1 unité correspond à une augmentation des ions H+ de 26% (comme l’indiquait le dernier rapport du GIEC), ce qui est considérable. Ce qui est inquiétant c’est que ces modifications ont déjà des effets sur le comportement des animaux marins et leur faculté de survivre et de se reproduire, et qu’elles menacent les coraux (avec la température qui augmente aussi). De plus, malheureusement, l’impact humain s’accélère, ce qui laisse entrevoir des répercussions de plus en plus importantes.
Quand on combine les effets du PH, de la hausse de la température, la surpêche, ainsi que les phénomènes d’eutrophisation et d’anoxie près des cotes, on peut dire que la situation n’est pas encourageante, c’est le moins que l’on puisse dire. Et évidemment, il y a toutes autres modifications/altérations que les activités humaines occasionnent (déforestation, pollution, etc.). Je dirais même qu’il y a de quoi être éco-anxieux, sinon pour nous, du moins pour nos enfants…