Le réchauffement planétaire résulte de l’absorption des rayonnements infrarouge (IR) issus de la surface terrestre par des gaz d’origine anthropique rejetés dans l’atmosphère. Sans ces rejets, dits gaz à effet de serre (GES), ces radiations quitteraient la Terre et iraient se perdre dans l’espace. En étant emprisonné, ce rayonnement dit « thermique » réchauffe l’atmosphère. Mais pourquoi les radiations IR sont-elles bloquées ?
Le phénomène d’absorption IR
La matière n’est pas totalement statique. Du fait que les corps que nous côtoyons sont « chauds » (plus précisément que leur température est plus élevée que le zéro absolu), les atomes qui composent les molécules vibrent constamment. C’est l’existence de différents états de vibrations qui est à l’origine de l’absorption IR. La mécanique quantique explique que les niveaux d’énergie des vibrations sont quantifiées : les niveaux d’énergie vibrationnelle ne peuvent prendre que certaines valeurs.
Lire la version PDF de cet article
Les molécules absorbent plus ou moins le rayonnement IR, sauf des molécules totalement symétriques comme l’oxygène moléculaire (O2). Ce sont les liaisons qui relient les atomes des molécules qui absorbent à certaines fréquences (c’est-à-dire à certaines énergies). Lorsqu’une liaison reçoit une radiation, elle l’absorbe et change de niveau d’énergie de vibration. Il se trouve que ces différences de niveaux d’énergie correspondent à des fréquences situées dans le domaine IR du spectre électromagnétique.
La vision de la mécanique classique est différente et complémentaire : l’absorption par les molécules a lieu si la liaison considérée subit une variation de son moment dipolaire lors de son interaction avec le rayonnement IR. Le moment dipolaire d’une liaison dépend de la charge électrique portée par les atomes qui la constituent et la distance qui les sépare. Par exemple, pour deux atomes de charge électrique +q et –q séparés par une distance d, le moment dipolaire μ est donnée par :
μ =q.d.
Le moment dipolaire est d’autant plus élevé que la charge et la distance sont grandes. En général, une liaison fortement polarisée aura une absorption IR intense, mais ce qui compte réellement c’est la variation du moment dipolaire lors de l’interaction avec la lumière. Les liaisons chimiques peuvent être le siège de différents types de vibration : élongations et déformations (pliage, torsion, etc.). Toutes les liaisons chimiques et tous les types de vibrations n’ont évidemment ni la même fréquence ni la même intensité. Une molécule peut donc avoir plusieurs bandes d’absorption, avec des intensités différentes, puisque plusieurs liaisons sont présentes et de multiples modes de vibration sont possibles.
 Une molécule non linéaire a 3N-6 modes de vibration, où N est le nombre d’atomes de la molécule. Pour une molécule linéaire comme le CO2, il y a 3N-5 modes vibrationnels. En fait, pour connaître le nombre exact de modes, il faut également considérer la symétrie de la molécule, car c’est la symétrie qui détermine si un mode est actif ou inactif en IR (c’est-à-dire s’il y a bien une variation du moment dipolaire).
Une molécule non linéaire a 3N-6 modes de vibration, où N est le nombre d’atomes de la molécule. Pour une molécule linéaire comme le CO2, il y a 3N-5 modes vibrationnels. En fait, pour connaître le nombre exact de modes, il faut également considérer la symétrie de la molécule, car c’est la symétrie qui détermine si un mode est actif ou inactif en IR (c’est-à-dire s’il y a bien une variation du moment dipolaire).
Critères généraux d’un composé pour agir comme GES
L’ensemble des bandes d’absorption constitue le spectre d’absorption de la molécule. Les plus importantes sont situées en général dans la fenêtre dite « IR moyen» comprise entre 400 et 4000 cm-1 (en spectroscopie IR, plutôt que de donner la fréquence ou la longueur d’onde d’une raie d’absorption, on donne le nombre d’ondes, et l’unité usuelle est le cm-1). Mais pour qu’une bande d’absorption contribue à l’effet de serre, il faut qu’elle soit située dans la gamme spectrale de rayonnements émis par la surface de la Terre (voir le spectre émis par la Terre dans l’article sur l’effet de serre), soit entre 800 et 1400 cm-1.
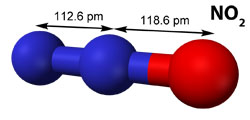 L’efficacité intrinsèque d’une molécule au forçage radiatif (c’est-à-dire à réchauffer la planète), que l’on appellera par la suite efficacité radiative, va donc dépendre du nombre de bandes d’absorption situées dans cette gamme de nombre d’ondes et de leur intensité d’absorption. Cette dernière est, en première approximation, proportionnelle au carré de l’amplitude de la variation du moment dipolaire considéré. L’efficacité radiative d’un GES se calcule par la somme des intensités intégrées, Iint, de toutes les bandes situées dans la gamme atmosphérique IR. Les spécialistes du domaine expriment cette intensité en km/mol.
L’efficacité intrinsèque d’une molécule au forçage radiatif (c’est-à-dire à réchauffer la planète), que l’on appellera par la suite efficacité radiative, va donc dépendre du nombre de bandes d’absorption situées dans cette gamme de nombre d’ondes et de leur intensité d’absorption. Cette dernière est, en première approximation, proportionnelle au carré de l’amplitude de la variation du moment dipolaire considéré. L’efficacité radiative d’un GES se calcule par la somme des intensités intégrées, Iint, de toutes les bandes situées dans la gamme atmosphérique IR. Les spécialistes du domaine expriment cette intensité en km/mol.
Au total, l’impact qu’un GES va avoir sur le réchauffement de la planète tient donc à son efficacité radiative intrinsèque, mais aussi à sa concentration et à son temps de vie dans l’atmosphère. La concentration dépend évidemment des rejets des activités humaines, tandis que le temps de vie dépend de l’affinité ou de la résistance de la molécule à certains agents atmosphériques, par exemple les radicaux hydroxyles.
Une panoplie de GES
 Actuellement, les trois GES prépondérants sont dans l’ordre : le dioxyde de carbone (CO2), le méthane (CH4) et les oxydes nitreux (NOx). Il se trouve que CO2, le CH4 et le dioxyde d’azote (NO2) ont des intensités dans la fenêtre atmosphérique relativement faibles, respectivement 25.7, 44.1, and 13.6 km.mol-1 (voir le tableau ci-bas). C’est à cause de leur grande concentration, notamment celle du CO2, que ces GES contribuent intensément à l’effet de serre, mais d’autres molécules commencent à poser problèmes ; il s’agit des composés halogénés.
Actuellement, les trois GES prépondérants sont dans l’ordre : le dioxyde de carbone (CO2), le méthane (CH4) et les oxydes nitreux (NOx). Il se trouve que CO2, le CH4 et le dioxyde d’azote (NO2) ont des intensités dans la fenêtre atmosphérique relativement faibles, respectivement 25.7, 44.1, and 13.6 km.mol-1 (voir le tableau ci-bas). C’est à cause de leur grande concentration, notamment celle du CO2, que ces GES contribuent intensément à l’effet de serre, mais d’autres molécules commencent à poser problèmes ; il s’agit des composés halogénés.
Certaines de ces substances (bromure de méthyle, chlorofuorocarbures (CFC) et hydrochlorfluorocarbures (HCFC)), utilisées principalement dans les systèmes frigorifiques, sont tristement célèbres car ils sont en grande partie à l’origine du trou de la couche d’ozone. En vertu du protocole de Montréal signé en 1987, ils sont progressivement remplacés par d’autres molécules peu ou pas dommageables pour l’ozone stratosphérique, mais perdurent cependant encore dans l’atmosphère. Par ailleurs, ces molécules de remplacement sont aussi des GES, tout comme le sont les CFC et HCFC.
 On retrouve ainsi dans l’atmosphère un vrai cocktail de molécules : en plus des molécules visées par le protocole de Montréal dont la concentration devrait diminuer progressivement, on compte des hydrofluorocarbures (HFC), des perfluorocarbures (PFC), ou des éthers hydrofluorés (HFE). Ces molécules sont utilisées dans nombre d’applications, par exemple en électronique, dans la fabrication des tapis ou comme traceur atmosphérique. Quoique présents en traces, ces composés ont des efficacités radiatives extrêmement élevées ainsi que des temps de vie extrêmement longs (voir les tableaux dans l’article sur le forçage radiatif et le tableau ci-bas). Ces GES ont donc des effets nuisibles aussi bien à court qu’à long terme.
On retrouve ainsi dans l’atmosphère un vrai cocktail de molécules : en plus des molécules visées par le protocole de Montréal dont la concentration devrait diminuer progressivement, on compte des hydrofluorocarbures (HFC), des perfluorocarbures (PFC), ou des éthers hydrofluorés (HFE). Ces molécules sont utilisées dans nombre d’applications, par exemple en électronique, dans la fabrication des tapis ou comme traceur atmosphérique. Quoique présents en traces, ces composés ont des efficacités radiatives extrêmement élevées ainsi que des temps de vie extrêmement longs (voir les tableaux dans l’article sur le forçage radiatif et le tableau ci-bas). Ces GES ont donc des effets nuisibles aussi bien à court qu’à long terme.
Critères plus spécifiques pour agir comme GES
 La particularité des composés halogénés est de contenir des atomes de brome (Br), de chlore (Cl) et de fluor (F). Ces deux derniers atomes sont connus pour être très électronégatifs, c’est-à-dire qu’ils attirent les électrons des atomes adjacents. Par conséquent, les atomes voisins ont tendance à acquérir une charge positive. Cet effet à pour résultat de créer des liaisons fortement polarisées X−Cl et surtout X−F (où X est un atome quelconque, souvent un atome de carbone (C)), ce qui conduit à des absorptions intenses en IR. Les composés halogénés ont donc en général des efficacités radiatives élevées.
La particularité des composés halogénés est de contenir des atomes de brome (Br), de chlore (Cl) et de fluor (F). Ces deux derniers atomes sont connus pour être très électronégatifs, c’est-à-dire qu’ils attirent les électrons des atomes adjacents. Par conséquent, les atomes voisins ont tendance à acquérir une charge positive. Cet effet à pour résultat de créer des liaisons fortement polarisées X−Cl et surtout X−F (où X est un atome quelconque, souvent un atome de carbone (C)), ce qui conduit à des absorptions intenses en IR. Les composés halogénés ont donc en général des efficacités radiatives élevées.
Le tableau ci-dessous donne le temps de vie, le « Global Warming Potential » (GWP), l’intensité IR totale, l’intensité entre 800 et 1400 cm-1 (efficacité radiative), ainsi que le pourcentage de l’intensité IR qui se situe dans la fenêtre atmosphérique de certains GES. À titre d’exemple, des composés fluorés comme le fréon 12 ou le SF5CF3 ont respectivement des efficacités radiatives de 970,1 et 1823 km/mol.
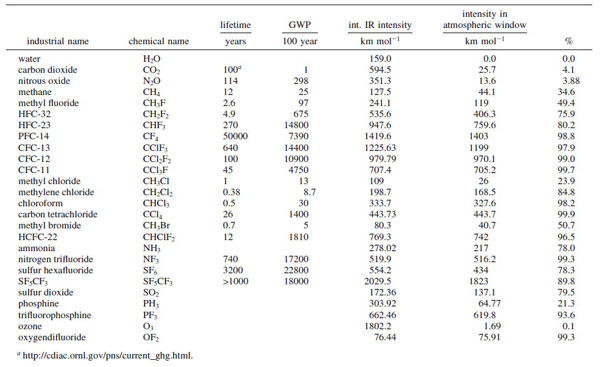
Le fluor étant l’atome le plus électronégatif, les molécules fluorées forment en général les GES les plus « efficaces ». Le fluor, et à un degré moindre le chlore, présentent le désavantage d’avoir des vibrations d’élongation C−F et C−Cl qui sont non seulement intenses, mais qui tombent en plus dans la fenêtre atmosphérique IR, ce qui n’est pas le cas pour la vibration d’élongation C−H. La figure ci-dessous montre que le pourcentage de bandes d’absorption d’une molécule augmente quand le nombre d’atomes de fluor augmente :
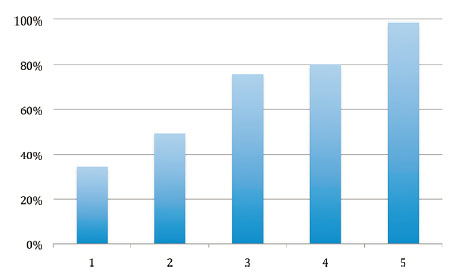
Un autre critère important est le nombre d’atomes de F ou de Cl qui sont liés sur un même atome central : à mesure que ce nombre augmente, cet atome central voit sa charge positive augmenter et on observe une polarité élevée des liaisons, donc une absorption IR forte.
Conclusions
Ces molécules, dont on commence à mieux comprendre l’efficacité radiative au niveau moléculaire, sont des GES particulièrement absorbants dans le domaine IR. Leur longue durée de vie dans l’atmosphère aura des répercussions sur plusieurs générations. Ces substances devraient être utilisées avec circonspection.
Sources :
Texte : Partha Bera, Joseph Francisco et Timothy Lee, Identifying the molecular origin of global warming J. Phys. Chem. A 113 (2009) 12694–12699.
Images :
Atmosphère de la Terre :
- Collection : NASA Image of the Day Gallery
- Titre : Thin Blue Line
- Description : fine ligne due à l’atmosphère de la Terre éclairée par le Soleil, photographiée par l’équipage de la station spatiale internationale alors que la navette Atlantis était arrimée à la station lors de la mission STS-129.
- Date : 25 novembre 2009
- Lien : http://www.archive.org/details/407255main_iss021e031766_hires_full
Structures moléculaires :
Toutes les images de structure moléculaire ont été téléchargées sur Wikipedia (http://en.wikipedia.org) et appartiennent au domaine publique exceptée celle du fluoroforme qui est sous licence GNU Free Documentation License, version 1.2 ou n’importe quelle autre version publiée par The Free Software Foundation. Les auteurs des images sont donnés ci-dessous :
- CO2 : Benji9072
- NO2 : Benjah-bmm27.
- CH4 : Ben Mills
- CHF3 (HFC-23 ou fluoroform ou trifluoromethane) : Mario58
- CCl2F2 (CFC-12, fréon 12 ou dichlorodifluoromethane) : Edgar181



