La couche d’ozone et son effet protecteur
L’ozone (nom féminin du grec ozein qui signifie « exhaler une odeur ») a pour formule chimique O3. La concentration de l’ozone dans l’atmosphère est très ténue : il n’y a que quelques molécules d’ozone pour un million de molécules d’air. Quatre-vingt dix pourcents de l’ozone atmosphérique se retrouve dans une couche située entre 15 et 50 km au dessus de la surface terrestre, selon une concentration qui varie avec l’altitude comme illustré sur la figure ci-dessous :
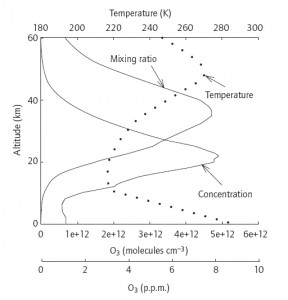
Cette couche, parfois appelée ozonosphère, s’est formée durant la longue histoire de la Terre et de son atmosphère. La répartition de la concentration en ozone en fonction de l’altitude telle qu’on l’observe actuellement résulte d’un équilibre entre différentes réactions chimiques qui impliquent l’oxygène de l’air, l’ozone et les rayons UV solaires. L‘ensemble de ces réactions est connu sous le nom de mécanisme de Chapman, du nom de Sidney Chapman, celui qui l’a développé dans les années 30.
L’ozone de la stratosphère est formée principalement par la photolyse de l’oxygène, plus spécialement par la dissociation de l’oxygène moléculaire (O2) en oxygène atomique (O) sous l’effet des rayons UV, un processus qui nécessite une longueur d’onde inférieure à 240 nm. Celui-ci se combine avec l’oxygène moléculaire pour former de l’ozone :
O2 + hϑ → O + O (1)
O + O2 + M → O3 + M (2)
M est une molécule de l’atmosphère, N2 ou O2 (ces deux gaz représentent 99% de l’atmosphère).
Sous l’effet du rayonnement UV (en fait, pour des longueur d’onde comprises entre 225 et 275 nm), les molécules d’ozone sont photodissociées, et se reforment selon les réactions suivantes :
O3 + hϑ → O2 + O (3)
O + O2 + M → O3 + M (2)
L’ozone est également perdue par la réaction :
O + O3 → O2 + O2 (4)
Le bilan net qui résulte de ces réactions est une concentration stationnaire en ozone. Les variations verticales de la concentration (figure ci-dessus) s’expliquent qualitativement (et quantitativement) à partir de la variation de ces réactions avec l’altitude. À haute altitude (au-dessus de 60 km), le rayonnement est intense et, bien que l’oxygène moléculaire soit présent, c’est l’oxygène atomique qui est prépondérant. À de telles altitudes, la densité de l’air est très basse de sorte que la probabilité pour l’oxygène moléculaire de réagir avec les atomes d’oxygène, et ainsi de former de l’ozone, est faible. Lorsque l’on descend en altitude la densité de l’atmosphère augmente et la concentration en ozone augmente (voir plus de détails sur le profil vertical de concentration en ozone). À plus basse altitude (en-dessous de 20 km d’altitude), l’épaisseur de la couche atmosphérique traversée (la colonne atmosphérique, comme on l’appelle) devient assez grande pour qu’une grande partie du rayonnement UV soit absorbé, ce qui limite la photolyse de l’oxygène et par suite la formation d’ozone. Le maximum de l’ozone se trouve ainsi autour de 22 km au-dessus du niveau de la mer (pour une concentration correspondante de de 0,0012% en mole). À basses altitude c’est l’oxygène moléculaire qui domine.
L’ozone a joué un rôle primordial sur l’apparition de la vie et est encore essentielle pour l’humanité car elle absorbe une grande partie des rayons UV qui sont très dangereux pour le règne du vivant. L’atmosphère laisse passer les UV A (315-400 nm), mais bloque les UV B (315-280 nm). Ces radiations peuvent causer des dommages sur l’ADN, l’ARN et sur les protéines. Aussi, l’absorption du rayonnement UV par l’ADN peut-elle provoquer des mutations cancérigènes. Malheureusement, la diminution actuelle de la teneur en ozone entraîne une augmentation des rayons UV B qui atteigent la surface terrestre. Il est bien connu que cette réduction de l’ozone stratosphérique a pour effet de permettre à davantage de rayonnements UV B d’atteindre le sol, conduisant ainsi à un accroissement des cancers de la peau dans la population.
Dans les années 60, les chercheurs se sont rendus compte que le bilan des réactions de Chapman ne pouvait expliquer la concentration mesurée d’ozone dans la stratosphère. Il s’est avéré que la vitesse de la réaction (4) était trop faible. Il devait exister une autre réaction, plus rapide, qui devait intervenir. C’est dans les années 70 que des chercheurs se sont rendus compte que certaines substances causaient une diminution de la concentration en ozone dans l’atmosphère. Le « trou » dans la couche d’ozone au-dessus de la calotte l’Antarctique a lui été découvert au début des années 80.
Ne pas confondre l’ozone stratosphérique et l’ozone troposphérique
De l’ozone est également présente dans les basses couches de l’atmosphère (en dessous de 12 km de la surface terrestre) ; on parle alors d’ozone troposphérique et elle représente environ 10 % de l’ozone totale. Cette ozone constitue, avec les particules fines dispersées dans l’atmosphère, l’un des éléments principaux d’un certain type de brouillard jaune-beige appelé smog que l’on retrouve en suspension surtout au-dessus des agglomérations (smog est un mot anglais, une contraction de smoke « fumée » et fog « brouillard »). La formation de l’ozone troposphérique résulte de différentes réactions qui impliquent le rayonnement UV du soleil, l’oxygène moléculaire, les composés organiques volatils (COV) et le dioxyde d’azote (NO2), un polluant émis par la combustion des énergies fossiles dans les automobiles, les cheminées, les centrales et les incinérateurs.
Le résultat global est un déséquilibre des réactions en faveur de la production d’ozone. Si l’ozone nous protège quand elle se trouve à haute altitude, elle est particulièrement nuisible pour la santé humaine dans la troposphère, car c’est une molécule instable et oxydante qui peut attaquer des molécules organiques complexes et causer des irritations des muqueuses et du système respiratoire. L’ozone troposphérique affecte également la flore et la faune. De fortes concentrations diminuent le rendement des récoltes et la croissance des forêts. L’ozone joue un grand rôle sur le smog de l’été, mais le smog n’est pas un phénomène uniquement estival. Les froides températures et le faible rayonnement UV du soleil de l’hiver ne favorisent pas la formation d’ozone en basse atmosphère (l’index UV augmente avec la hauteur du soleil dans le ciel), ce qui fait que le smog est alors dominé par les particules fines en hiver.
Quels produits détruisent l’ozone et que deviennent-ils ?
Les principales substances destructrices de l’ozone (SDO) sont des composés chlorés et bromés, notamment les CFC. Parmis ceux-ci on trouve par exemple le fréon 11 (CFCl2), le fréon 12 (CF2Cl3) ou le tétrachlorure de carbone (CCl4). Parmi les composés bromés, les principaux sont les halons, tels que l’halon 1211 (CBrClF2) et l’halon 1301 (CBrF3). On trouve aussi le bromure de méthyle (CH3Br) qui a des sources d’émissions naturelles et anthropiques. Les quantités de composés chlorés présents dans l’atmosphère sont deux ordres de grandeurs plus importantes que celles des composés bromés. Voir la liste des SDO sur le site de l’Agence de la Protection de l’Environnement des Etats-Unis. Les CFC sont des émanations anthropiques qui sont principalement utilisées dans les aérosols, les systèmes de réfrigération et de climatisation, et comme agent gonflant pour les mousses synthétiques. Du fait de leur longue durée de vie (typiquement, 50 à 100 ans), ces composés halogénés peuvent atteindre de hautes altitudes. Bien qu’elles soient émises essentiellement aux États-Unis, en Europe et en Asie, les SDO se répartissent dans toute la stratosphère. En effet, au-dessus de la tropopause (la couche qui sépare la troposhère de la stratosphère), vers 15 km d’altitude, la circulation de l’air homogénéise les couches d’air autour de l’ensemble de la planète.
Durant leur périple dans l’atmosphère, qui se mesure en décennies, les SDO sont photo-dissociées par les rayons UV du soleil pour libérer des atomes de chlore ou de brome. Ceux-ci vont réagir en phase gazeuse avec du méthane pour former de l’acide chlorhydrique (HCl) ou avec de l’ozone pour former le monoxyde chlore (ClO), qui va alors réagir avec le dioxyde d’azote (NO2) pour constituer du nitrate de chlore (ClONO2). Le même phénomène a lieu pour le brome avec la formation de monoxyde de brome (BrO) qui aboutit à celle du nitrate de brome (BrONO2). Le NO2 est un composé de l’atmosphère qui a une origine essentiellement anthropique comme nous l’avons vu plus haut, mais qui aussi une origine naturelle (activité microbienne du sol, foudre, combustion de la biomasse) [Lee et coll. Atmos. Envir. 31 (1997) 1735-1749]. Le bilan global des réactions impliquant les SDO est que, quelque soit le processus, la dissociation des SDO aboutit à la formation des substances non réactives HCl, ClONO2 et BrONO2, sans destruction d’ozone. Ces molécules forment en fait un « réservoir » qui va avoir un rôle important dans la suite. Si ce n’était pas des conditions extrêmes des pôles, et surtout de l’Antarctique, le trou n’existerait pas.
Comment se forme le trou de la couche d’ozone ?
La trou de la couche d’ozone désigne un volume de la couche stratosphérique située au-dessus du continent Antarctique qui subit une réduction très marquée de la concentration en ozone. Son pendant existe également au-dessus de l’Arctique mais il est beaucoup moins prononcé. Comme image, on pourrait qu’il s’agit davantage d’un « fossé » en Arctique que d’un « trou ». Le trou de la couche d’ozone est un phénomène saisonnier. Il se concentre plus particulièrement dans les basses couches de la stratosphère, se forme plus particuièrement au printemps (septembre-octobre pour la zone antarctique et mars-avril pour la zone arctique) et dure environ deux mois par an. Cependant, sa durée, de même que son étendue latérale et verticale, peuvent varier notamment selon les conditions météorologiques et la quantité de SDO présents. Il en est de même pour l’amplitude des conséquences que ce(s) trou(s) peut (peuvent) avoir à d’autres latitudes. Pour donner un ordre d’idée, à son maximum, en 2006, le trou en Antarctique a couvert une surface de 27 millions de km2 (soit environ 5% de la surface de la stratosphère).
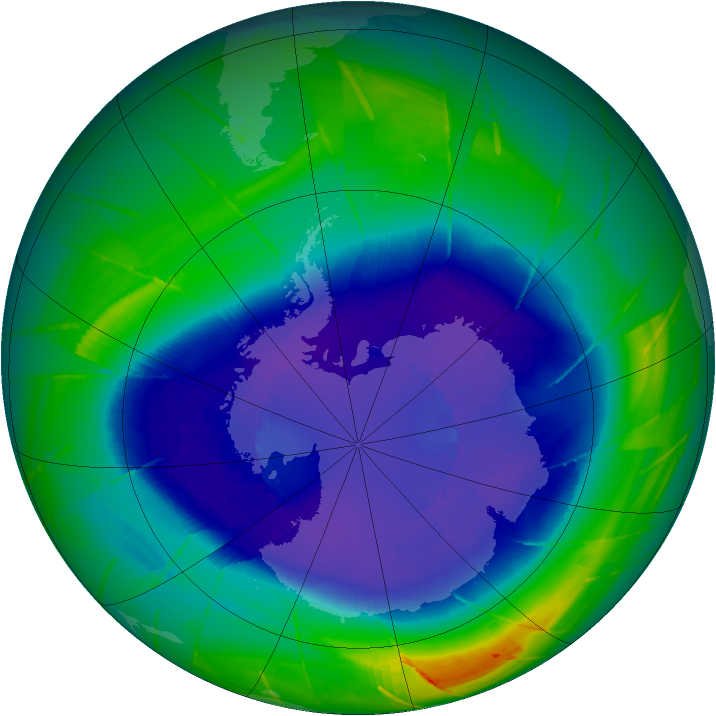
L’origine du trou de la couche d’ozone tient aux conditions très particulières qui règnent dans ces régions. L’hiver, durant la longue nuit polaire, lorsque les températures sont extrèmement basses, il se forment au-dessus des calottes polaires des nuages particuliers, les nuages stratosphériques polaires (ou PSC pour polar stratospheric clouds).

Ces nuages restent concentrés au-dessus de l’Antarctique sous l’effet de vents tourbillonnants appelé vortex polaire qui est dû à la force de Coriolis. Ces nuages sont constitués de cristaux de glace (nuages de type I) ou de particules d’acide nitrique concentré (nuages de type II), probablement de l’acide nitrique trihydraté (HNO3.3(H2O)) sous forme cristalline. Du fait de la grande sécheresse de l’air à ces altitudes, la formation de glace requiert de très basses températures. À titre indicatif, la concentration en eau dans la stratosphère est de 5 ppmv, ce qui correspond à une humidité relative inférieure à 1% à 20 km d’altitude. À ces concentrations, la température doit être inférieure à 188K (-88°C) pour l’eau condense, ce qui est le cas durant l’hiver antarctique.
Sur ces cristaux et particules vont venir précipiter les molécules de HCl, ClONO2 et BrONO2 du réservoir, et des réactions chimiques hétérogènes (réactions qui se déroulent à la surface de solides), qui n’ont pas lieu dans des conditions atmosphériques « normales », vont se produire dans les nuages stratosphériques polaires. Le HCl va se dissoudre dans les cristaux et, lorsque le ClONO2 rencontre de tels cristaux, les réactions suivantes ont lieu :
ClONO2(g) + HCl(s) → Cl2(g) + HNO3(s)
ClONO2(g) + H2O(s) → HOCl(g) + HNO3(s)
(« g » signifie gaz et « s » solide)
L’acide nitrique HNO3 reste sous forme solide dans les nuages et les substances Cl2 et HOCl sont en phase gazeuse. Ces substances sont aisément photo-dissociées par le rayonnement solaire, même durant le sombre hiver polaire, alors que les fréquences UV sont encore fortement filtrées du fait de l’épaisse couche atmosphérique que les ondes électromagnétiques doivent parcourir. Le chlore moléculaire absorbe en effet les rayonnements visibles et proches UV selon le processus :
Cl2 + hϑ → 2Cl (3)
Cl + O3 → ClO + O2
Cela a pour effet de produire de grandes quantités des radicaux libres Cl (atome de chlore) et ClO (monoxyde de chlore), des espèces très réactives qui sont directement impliquées dans les réactions catalytiques destructrices d’ozone comme nous allons le voir et peu plus bas. De façon similaire se forme l’espèce BrO (monoxyde de brome).
En fait, le ClO devrait normalement être capturé par le NO2 (comme on l’a vu ci-dessus), et retourner dans l’inoffensif réservoir de ClONO2. Mais, la chimie des nuages stratosphériques polaires nous réserve encore des surprises. D’autres réactions se produisent à la surface des cristaux, notamment des réactions qui impliquent le pentoxyde d’azote (N2O5) :
N2O5 + H2O → 2 HNO3
N2O5 + HCl → ClNO2 + HNO3
Ces réactions réduisent la concentration de pentoxyde d’azote. Et comme ce composé est en équilibre avec le NO et le NO2 (par la réaction : 2 N2O5 ↔ 4 NO2 + O2), il a y une réduction globale de la réserve en NO2. Ceci a pour conséquence de laisser le champ libre aux dommageables molécules de ClO de rester en concentrations élevées. Cette réduction en oxydes nitriques de type NOx qui se convertit en acide nitrique s’appelle dénoxification et joue un rôle important dans la formation du trou de la couche d’ozone.
De plus, les nuages constitués d’acide nitrique sont à l’origine d’un phénomène appelé dénitrification qui se définit comme une perte en azote. En effet, sous l’effet de la gravité, les particules d’acide nitrique hydraté sédimentent dans de plus basses couches atmosphériques. Par exemple, une particule de 1 mm de diamètre tombe de 20 km d’altitude à 10 km en moins d’un an. Si l’acide nitrique restait présent dans la stratosphère, une photolyse aurait lieu et formerait du NO2 qui capturerait le ClO, mais la disparition de l’acide nitrique (dénitrification), tout comme la dénoxification, laisse le champs libre au ClO pour produire ses effets néfastes.
Ainsi, lorsque le soleil réapparaît au début du printemps, la stratosphère voit sa concentration en Cl et en ClO s’accroître et ces molécules vont participer à des réactions catalytiques qui détruisent l’ozone tout en régénérant le chlore. Un radical chloré peut donc détruire des milliers de molécules d’ozone selon les réactions suivantes :
ClO + ClO + M → (ClO)2 + M
(ClO)2 + hϑ → Cl +ClOO
ClOO + M → Cl + O2 + M
2(Cl + O3) → 2(ClO + O2)
(où M est une molécule de l‘atmosphère)
Bilan net : 2 O3 → 3 O2
Ces réactions sont responsables de 95% de la perte en ozone. Environ 75% de l’ozone restant serait perdu par des réactions impliquant le brome :
ClO + BrO → Cl + Br + O2
Cl + O3 → ClO + O2
Br + O3 → BrO + O2
Bilan net : 2 O3 → 3 O2
Au pic des réactions, la diminution de la teneur en ozone au-dessus de l’Antarctique peut atteindre 70%. Enfin, quand le réservoir de molécules chlorées et bromées est épuisé, la couche d’ozone se reconstitue. L’exemple de la couche d’ozone illustre bien que les émissions de nos sociétés se retrouvent dans l’atmosphère, polluent et affectent la santé humaine, mais en plus, qu’il se produit parfois des phénomènes complexes et imprévisibles, sur lesquels nous n’avons aucun contrôle.
La perte en ozone est particulièrement prononcée pour ce qui est de la zone antarctique. En effet, la présence d’un continent (sous l’antarctique) et le fait que le continent soit élevé (3000 mètres environ) conduit à un refroidissement plus intense durant l’hiver comparé au refroidissement qui a lieu au-dessus de la zone polaire nord. Le vortex polaire est également plus faible qu’au pôle sud. Les nuages stratosphériques perdurent donc plus longtemps en Antarctique qu’en Arctique et la « soupe chimique » qui se crée lors de la formation de nuages dans l’air agit plus longuement qu’au pôle nord.
Mais la couche d’ozone ne se résume pas qu’aux trous qui se forment aux pôles. Le vortex polaire de l’Antarctique faiblit vers novembre, de sorte qu’à la fin du printemps, l’air particulièrement pauvre en ozone de l’Antarctique commence à se mélanger et à s’homogénéiser avec l’air se trouvant plus au nord, entraînant un appauvrissement en l’ozone de l’air situé au-dessus de la partie sud de l’Amérique du Sud, l’Australie et de la Nouvelle-Zélande. Aux latitudes moyennes (40-60°), on observe une diminution de 5 à 6% de la concentration en ozone en hiver et au printemps (pour fixer les idées Montréal est à 45°N). Quant à la la zone tropicale, la teneur en ozone est stable et inchangée.
Y-a-t-il des liens entre le réchauffement planétaire et le trou de la couche d’ozone ?
Les CFC, cible principale du protocole de Montréal, sont en train d’être remplacés par des agents moins nocifs pour la couche d’ozone, notamment les hydrofluorocarbones (HFC) et les hydrochlorofluorocarbones (HCFC). Mais, si leur potentiel destructeur de l’ozone est moindre, ces gaz sont aussi de puissants gaz à effet de serre (GES). On peut donc se demander si résoudre un problème ne va pas en agraver un autre.
Dans cette optique, il ne faut pas oublier que les CFC et les SOD en général, sont, eux aussi, des GES. Ainsi, une étude parue en mai 2007 dans les Proceedings of the National Academy of Science des États-Unis [Velders et coll. PNAS 104 (2007) 4814-4819] montre les bienfaits présents et à venir de l’application scrupuleuse du protocole de Montréal sur la protection du climat. En effet, en se basant sur les émissions effectives de SDO et différents scénarios d’émissions futures, la contribution au forçage radiatif des SDO aurait été plus important si la communauté internationale n’avait pas été l’objet d’une réglementation stricte. Le protocole de Montréal, et ses amendements passés et futurs, s’avèrent donc un moyen efficace pour compléter avantageusement le protocole de Kyoto dans la lutte au réchauffement planétaire.
L’augmentation des GES n’a pas seulement pour conséquence de réchauffer la planète, elle diminue aussi la température de la stratosphère, notamment en Arctique. Par suite, la formation des nuages stratosphériques polaires pourrait s’intensifier dans cette région, notamment par une durée d’existence plus longue. Une augmentation suffisante pourrait ainsi en principe créer un trou équivalent à celui de l’Antarctique. Selon un modèle présenté dans un article de la revue Nature [Austin et coll. Nature 360 (1992) 221-225], un doublement la teneur en CO2 dans l’atmosphère par rapport à la teneur de 1992 pourrait conduire à une diminution de 100% de la concentration en ozone dans les basses couches stratosphériques.
Comme on peut le voir, et comme on pouvait s’y attendre, le trou de la couche d’ozone et le réchauffement climatique sont des phénomènes qui sont intimement liées. Autrement dit, les composés émis par l’humanité depuis l’ère industrielle sont impliqués dans des processus complexes et variés qui affectent fortement l’ensemble de la physico-chimie de l’atmosphère.
Le problème de l’ozone n’est pas réglé mais devrait s’améliorer
Le Protocole de Montréal est unanimement reconnu pour être une belle réussite diplomatique, car les objectifs visés au départ sont en passe d’être atteints, les CFC n’étant presque plus utilisés aujourd’hui. On voit en effet, les évolutions des concentrations des SOD visées par le protocole Montréal commencer à s’infléchir. Cependant, il est encore trop tôt pour se réjouir. Premièrement parce que, contrairement à ce que d’aucun pourrait penser, le trou n’est pas résorbé. En 2009, il était de même taille que lors des 5 dernières années. Dans une entrevue donnée par Geir Braathen (Organisation Météorologique Mondiale) à la radio de Radio-Canada (émission les années lumières du 13 septembre 2009), les effets pourraient se faire sentir pendant encore 10 voire même 20 ans. En effet, les produits qui ont déjà été rejetés dans l’atmosphère sont très stables, vont donc y rester encore plusieurs années, et leurs effets pourront se faire sentir pendant aussi longtemps. On appelle cela un effet d’inertie.
De nouveaux produits détériorent l’ozone
Si l’utilisation des CFC diminue fortement, les activités humaines continuent de croître et de nouvelles molécules sont rejetées dans l’atmosphère. Le protoxyde d’azote ou oxyde nitreux (N2O, gaz anesthésiant, anciennement appelé gaz hilarant) par exemple est issu principalement de l’utilisation d’engrais à base d’azote en agriculture (épandage de fumier et de fertilisants). C’est la substance dont la production augmente le plus parmi les SDO et elle représente la plus grande menace pour l’ozone, même si les composés chlorés et bromés, ceux qui ont été émis par le passé et qui subsistent encore dans l’atmosphère, détruisent actuellement l’ozone en plus grande quantité. Les concentrations de ces substances diminuent peu à peu alors que la concentration en oxydes nitreux augmente. Ce dernier risque donc de prendre une place prépondérante dans le futur. Par ailleurs, l’oxyde nitreux est aussi un GES dont la contribution au forçage radiatif est pour l’instant de 6% [Davidson Nature Geoscience 2 (2009) 659-662].
Sources :
En dehors des références citées dans le texte, ce document est fondé sur les références suivantes :
- Hamill & Toon, Polar stratospheric clouds and the ozone hole Physics Today (1991) 34-42
- Claude Villeneuve & François Richard, Vivre les changements climatiques – Réagir pour l’avenir (2007) Editions Multimondes
- NASA :
– Ozone hole watch : http://ozonewatch.gsfc.nasa.gov/
– 20 questions about ozone : http://science.nasa.gov/headlines/y2006/images/ozone/20questions.pdf
- US National Oceanic and atmospheric Administration (National Weather Service) : http://www.cpc.ncep.noaa.gov/products/stratosphere/sbuv2to/ozone_hole.shtml
- Programme des Nations Unies pour l’Environnement (PNUE) :
– http://ozone.unep.org/french/
– http://www.uneptie.org/ozonaction/
- Agence Spatiale Canadienne : http://www.asc-csa.gc.ca/fra/satellites/scisat/ozone.asp
- Environnement-Canada :
– http://www.ec.gc.ca/ozone/FR/index.cfm
– http://www.ec.gc.ca/cleanair-airpur/caol/pollution_issues/cws/s2_f.cfm
- Santé-Canada :
http://www.hc-sc.gc.ca/ewh-semt/air/out-ext/effe/talk-a_propos-fra.php
- Les années Lumières – Émission du 13 septembre 2009 :
- Développement durable, environnement et parc Québec :
- http://www.mddep.gouv.qc.ca/jeunesse/chronique/2004/0401-smog.htm
- http://www.encyclo123.com/Climat/952.html
- http://www.theozonehole.com/
- http://www.faqs.org/faqs/ozone-depletion/antarctic/
- http://wwwens.uqac.ca/chimie/Cinetique_chimique/CHAP_6.html
- http://www.futura-sciences.com/fr/news/t/climatologie-1/d/le-protoxyde-dazote-nouvel-ennemi-de-la-couche-dozone_20357/


